إعداد :عمر العلي المحمد
إشراف
أ.د. محمود حمدي عداس
2011-2012
جدول المحتويات
أولا المعالجة الشعاعية Radiotherapy:
يُوظف العلاج الإشعاعي التطبيقات المختلفة للإشعاع المؤين في تقويض بُنية الخلايا السرطانية ومعالجة الأورام، بُغية القضاء عليها نهائياً، أو تقليص كتلة الورم على أقل تقدير.
هي استخدام أشعة ذات طاقة عالية high energy rays والتي تسبب أذيات في الخلايا الورمية ثم تموتها وكذلك تحد انتشار الورم. فالأشعة المؤينة تسبب تشكيل مركبات شاردية داخل الخلايا مثل H3O+ سامة على الخلية وقاتلة أو أنها تخرب المادة الوراثية.
تكون الأشعة موضعية ومركزة على مكان وجود الورم (علاجا موضعيا)، شأن الجراحة (خلاف العلاج الكيميائي)، وقد يتم استخدامه منفرداً كعلاج وحيد، أو بصفة مشتركة مع علاجات الأورام الأخرى.
- إستطبابات المعالجة الشعاعية:
- المريض غير ملائم للجراحة الكبرى
- لايمكن الوصول الى الورم او غير ممكن استئصاله تقنيا بواسطة الجراحة
- الجراحة تؤدي لحدوث عجز وظيفي شديد
- المريض لايرغب بالخضوع للجراحة
- مضاد إستطباب المعالجة الشعاعية:
- تشعيع موضعي سابق
- الاورام الكبيرة مع امتدادت ورمية عظمية وانتقالات ورمية للعقد اللمفية الرقبية
مريض غير كفئ للالتزام بالمعالجة خارج المشفى
أنواع الأشعة المستخدمة في العلاج:
بصفة عامة يمكن تصنيف الإشعاع المؤين إلى نوعين رئيسيين:
- الفوتونات(Photons) : و تشمل الأشعة السينية وأشعة جاما.
- إشعاع الدقائق: (particulate radiation) أو الجزيئات الدقيقة، ويشمل الالكترونات, البروتونات, النيوترونات, جزيئات آلفا (alpha particles) و بيتا (beta particles).
يتم ذلك إما باستخدام العناصر والنظائر المشعة، أو بتوليد دفق إشعاعي مؤجج وعالي الطاقة وتقليدياً يتم استخدام الأشعة السينية المولدة الكترونيا كمصدر للإشعاع، بجرعات عالية أضعاف المستخدمة بالأجهزة التصويرية.
- حزمة الكهربياتelectrons : مفيدة عند المعالجة الخارجية أو السطحية، مما يحمي الأنسجة المتواجدة عميقا.
- حزمة البروتونات : تتميز بأنها لا تسبب ضررا بالغا بالأنسجة التي تمر عبرها، بينما يتركز تأثيرها على خلايا الأنسجة التي توجد بنهاية مسار أشعتها بحقل المعالجة، مما يفيد في تسليط كمّ إشعاعي مكثف على الخلايا الورمية مع تقليل تعرض الخلايا والأنسجة المجاورة.
- حزمة النيوترونات: عادة تستخدم لمعالجة بعض أنواع الأورام بالرأس و الرقبة و البروستات.
وحدة قياس الجرعة
الوحدات المستخدمة لقياس معدلات وجرعات العلاج الإشعاعي:
وحدة القياس الأولية تسمى راد (Rad) (Radiation Absorbed Dose)، و الراد هو مقياس كمية الإشعاع التي يمتصها الجسم، أما وحدة القياس الأكثر شيوعا فتسمى جراي (Gray) (Gy), و هي تساوي 100 راد. كما يوجد عنها السنتيجري وتساوي راد واحد.
آلية المعالجة الشعاعية
تكمن فاعلية هذا العلاج في مقدرة الإشعاع على تدمير وتفتيت الحمض النووي بالخلايا السرطانية، وبصفة عامة فالخلايا التي تنمو وتتكاثر بوتيرة سريعة، شأن الخلايا السرطانية، هي أكثر حساسية تجاه مفعول الإشعاع وأشد تأثرا، ومع ذلك تتضرر الخلايا الطبيعية وإن كانت عموما قادرة على التعافي بحيوية اكبر، نظرا لمقدرتها على استخدام تقنيات الجسم الطبيعية لإصلاح و ترميم الأضرار الواقعة على الحمض النووي؛ يتوقف نجاح المعالجة الشعاعية على إمكانية التحكم في نمو الورم وايقافه دون إلحاق اذى خطير ودائم في الانسجة السليمة المجاورة. كما تبلغ الزيادة في الحساسية بين النسج السليمة و الورمية حوالي 20-25%.
آلية المعالجة الشعاعية
Five Rs:
Repair, Repopulation, Reoxygenation, Redistribution, Radiosensitivity.
الاصلاح Repair : يحدث ضرر في DNA الخلية, وبآلية الترميم والاصلاح يتم اصلاح الخلية الطبيعية , اما الورمية وبسبب كونها ضمن حالة انقسام يصبح الاصلاح اقل فعالية.
إعادة تكاثر Repopulation: قد تستغرق المعالجة مدة زمنية طويلة قد يحدث أثناءها اعادة تطور خلايا ورمية جديدة, لهذا قد يؤثر على جرعة الاشعة المدروسة للتحكم بالورم, ويصبح لدينا كجرعة ضائعة wasted radiation dose .
إعادة الاكسجة Reoxygenation: تأثر المعالجة الشعاعية بشكل اساسي على الخلايا المأكسجة بشكل جيد والتي تكون على محيط الورم وقريبة من التروية الدموية, على اية حال الخلايا الموجودة في مركز الورم تكون في حالة تنخر بسبب انعدام الاكسجين , ولكن يبقى خلايا اخرى تعاني من نقص الاكسجين وهي تبدي مقاومة تجاه الاشعة بسبب نقص الاكسجين, وعندما تقضي الاشعة على الخلايا المأكسجة عندها هذه الخلايا لاتستقلب الاكسجين وتسمح له بالانتشار الى الطبقات الاعمق الى الخلايا ناقصة الاكسجين وبذلك يحدث عكس لهذه الخلايا وتصبح مأكسجة من جديد عندها تتأثر بالاشعاع بشكل جيد.
إعادة التوزع Redistribution: الخلايا تكون حساسة اكثر تجاه الاشعة عندما تكون في الاطوار G1, early S, and G2/M . وعندما تكون الخلية في طور S المتأخر تكون اكثر مقاومة للاشعة. لذلك عندما نعطي الجرعة الشعاعية الثانية نأمل بان تكون الخلايا التي في الطور S المتأخر تصبح في طور اكثر حساسية تجاه الاشعة.
الحساسية تجاه الاشعة Radiosensitivity: هناك اختلاف بين الاورام من حيث الحساسية , بعضها حساس جدا للاشعة مثل الورم اللمفي وبعضها مقاوم للاشعة مثل الميلانوما. ومن الصعب احيانا تقدير حساسية الورم للاشعة. ومن المفيد اجراء اختبار الحساسية الشعاعية على الخزعة حيث عندها يمكن تقدير الجرعة الشعاعية او تحديد فيما اذا كانت المعالجة الشعاية مناسبة ام لا, ويمكن الاستعانة بالجداول المحددة مسبقا لحساسية الاورام تجاه الاشعة.
تقسم الاورام الى ثلاث انواع:
- الاورام الحساسة للاشعة (radiosensitive T.): وهي أورام يتم اجتثاثها بجرعات شعاعية منخفضة نسبيا, كالورم اللمفاوي والأورام الجنينية الناشئة خلال سن الطفولة في العقد العصبية والسرطان الغضروفي.
- الاورام متوسطة الحساسية للاشعة (moderately radiosensitive T.): مثل السرطانات الشائكة في الرأس والعنق
- الاورام المقاومة للاشعة (radioresistant T.): لا تستجيب للعلاج الشعاعي. كساركوما العظم والنسيج الضام و الورم القيتاميني و الورم الدبقي حيث هنا الاستئصال الجراحي ضروري للشفاء.
Therapeutic Ratio

Dose-response curves for tumor (solid line) and normal (dotted line) tissues. At a radiation dose of 70 Gy, 40% of tumors are cured but at the expense of severe long-term toxicity (grade 3 or greater) in around 5% of patients. Therefore, the complication-free cure rate is 35%. If the radiation dose is increased to 75 Gy, the cure rate increases to 60% but the normal tissue damage rate also increases to 35%, for a complication-free cure rate of only 25%. In this notional example, the complication-free cure rate decreases with an increase in radiation dose. For this reason, simple radiation dose escalation is not a viable strategy to achieve improved outcomes in treating head and neck cancer.
- العلاج الشعاعي الجذري او الاساسي (Radical radiotherapy):
وهو العلاج المراد به الشفاء, يستخدم هذا العلاج للمرضى ذوي الحالة العامة الجيدة و اللذين لديهم اورام محددة (limited tumor). الفترة العلاجية تكون طويلة و الجرعة المعطاة تكون مرتفعة (60-66gy _6 weeks ) يكون الجلسات 1,5-2غراي /4-5ايام عمل يتبعها 2-3 ايام راحة. ذلك بهدف احداث توازن مثالي بين امكانية شفاء الورم واذى النسيج الطبيعي حيث يمكن اعطاء فرصة للترميم بالنسبة للانسجة الطبيعية و زيادة التروية للنسج الورمية ( فرط التجزئة, التجزئة السريعة) حيث تكون التاثيرات الجانبية لا مفر منها و لكن هذه الاثار مقبولة كجزء متعذر اجتنابه من محاولة الشفاء. الاورام التي تعالج بالاشعة هي الشديدة الحساسية لها (الورم اللمفاوي, ورم المصوريات). او الاورام اظهرت فيها التجربة ان العلاج الشعاعي لوحده له معدل شفاء معقول.
سرطان شائك الخلايا 60gy اللمفوما 50gy .
- العلاج الشعاعي التلطيفي Palliative radiotherapy :
يستخدم عند تعذر العلاج الجذري إما بسبب ضخامة الورم مما يجعل استئصاله الجراحي مستحيل أو بسبب انتشاره العام عن طريق الدم و الفشل في السيطرة عليه, أيضا عندما تكون حالة المريض الصحية سيئة فيصبح غير قادر على تحمل المعالجة الجذرية. يراد بالعلاج التلطيفي تحسين نوعية حياة المريض عن طريق تخفيف الأعراض المزعجة, الوقاية من الاختلاطات المرتبطة بالورم.
تكون الجرعة في العلاجات الشعاعية التلطيفية اقل و تؤخذ خلال فترة زمنية اقصر من العلاجات الشافية و ذلك لتقليل انزعاج المريض و الاثار الجانبية (8-30 غراي/يوم – اسبوعين). وتتراوح عدد الجرعات من 1 الى 10 جرعات خلال اسبوعين عادة تكون 20 Gy مقسمة على 5 جرعات في الاسبوع. و اكثر ما يركز عليه هذا العلاج:
- تخفيف الالم كما في الانتقالات العظمية
- الانتقالات الدماغية
- النزف
- الانسدادات
- التقرح
- علاج الالم الحشوي
- العلاج الاسعافي
يتم استخدامه قبل المباشرة بالعمليات الجراحية للأورام، فيما يُعرف بالعلاج المبدئي المساعد (neoadjuvant therapy) بُغية تقليص حجم الورم لتسهيل استئصاله.
أو يتم استخدامه عقب جراحات الاستئصال كعلاج مُضاف ( adjuvant therapy ) بُغية القضاء على أية خلايا ورمية غير مميّزة قد تكون متبقية، أو عند تعذر الاستئصال التام للنسيج الورمي.
الجمع بين الأشعة والجراحة Combining between Radiation and Surgery:
الأساس المنطقي العام في الجمع بين الأشعة و الجراحة هو أن آلية القصور لهاتين التقنيتين مختلفة, فالأشعة نادرا ما تخفق في محيط الأورام حيث تكون الخلايا قليلة العدد وموعاة جيدا وعندما تخفق الأشعة يحدث الإخفاق في مركز الورم حيث توجد أعداد كبيرة من الخلايا الورمية واقعة عادة تحت ظروف نقص الأكسجة. فعندما تخفق الجراحة يكون السبب خلايا ورمية مجهرية موجودة في الأنسجة الطبيعية التي لم يشملها القطع. بالمقابل الجراحة تقيد بضرورة حفظ الأنسجة الحيوية السليمة المجاورة للورم. هكذا يتطلب العديد من الأورام الجمع بين الجراحة والأشعة.
فاستعمال الأشعة بعد الجراحة يؤدي لاجتثاث أي مرض متبقي وبالتالي ممكن الحصول معدلات جيدة لحفظ العضو عن طريق السماح بانجاز اقتطاعات اقل جذرية دون تعريض معدلات الشفاء للخطر.
أما استعمال الأشعة قبل الجراحة فيمكنه تعقيم محيط الأورام الكبيرة سامحا بعملية قطع محددة أكثر أو حتى جاعلا الاورام الغير قابلة للجراحة يقبل الجراحة. من هذه الاورام: سرطان جوف الفم, سرطان البلعوم السفلي.
الجراحة الإشعاعية Intraoperative Radiation Therapy (IORT):
أو العلاج الإشعاعي أثناء الجراحة حيث تدمج المعالجة الإشعاعية بالعمليات الجراحية، حيث مبدئيا يقوم الجراح باستئصال أكثر كمّ ممكن من أنسجة الورم.
و خلال العملية الجراحية، يتم تسليط جرعة عالية من إشعاع نحو مهد الورم ( أي الموضع الذي استؤصل منه)، مع مساحة من الأنسجة المجاورة تحسبا لانتقال الخلايا الورمية إليها، ويتم أحيانا استخدام هذه الطريقة بالإضافة إلى الإشعاع الخارجي، مما يضمن تسليط كمّ إشعاعي أكثر كثافة على الخلايا الورمية.
الجمع بين الأشعة والعلاج الكيماوي
Combining between Radiation and Chemotherapy
يعطى العلاج الكيماوي في معظم الحالات بقصد اجتثاث الانتقال المجهري البعيد Distant Micro Metastasis في حين ينصب العلاج الشعاعي على الضبط الموضعي Local Control للورم البدئي. مثل: سرطان الجملة العصبية المركزية (الورم النخاعي الارومي), لمفوما.
من العوامل التي شجعت على الجمع بين الاشعة والعلاج الكيماوي ازدياد طلب المحافظة على العضو, بحيث انه في بعض الحالات يمكن الاستغناء عن الجراحة باستعمال الاشعة مع العلاج الكيماوي كما في حالة علاج ابيضاض الدم ومن الممكن اعطاء الاشعة مع العلاج الكيماوي الى مجموعة من المرضى هامة وهم المرضى الغير قابلين للجراحة او القطع (In Operable Or Unresectable Patient) كالذين لديهم مرض متقدم او حالات مرضية مشاركة و التي تجعل الاخطار المصاحبة للتخدير والجراحة كبيرة و لكن ليست تلك المصاحبة للعلاج الشعاعي و الكيماوي.
و تم ايضا استعمال العلاج الكيماوي المتزامن مع العلاج الشعاعي لعدد مختلف من الاورام, هدف العلاج الكيماوي المتزامن هو تعزيز الضبط الموضعي للورم كون الجرعة المعطاة منخفضة جدا لكي يكون لها تأثير جهازي لافت للنظر وهو يعطينا ميزة من ناحية الضبط الموضعي للورم, ومن جهة اخرى يمكنه احداث سمية موضعية زائدة ضمن الانسجة المعرضة للاشعة و يمكن استعمال العلاج الكيميائي بقصد الشفاء بعد اخفاق الاشعة وهذا الاسلوب يعتبر ناجحا في الاورام شديدة الحساسية للعلاج الكيماوي كمرض هودجكن.
طرق العلاج الشعاعي
الإشعاع الداخلي Internal Radiation
و يُسمى أيضا بالإشعاع المزروع (implant radiation) أو العلاج الإشعاعي المقصور (brachytherapy) و يستخدم لدى العديد من الأورام، مثل أورام الرأس و الرقبة، أورام الشبكية، الثدي, الدرقية, الرحم و البروستات.
في هذا النوع من المعالجة يتم توظيف خاصية الإشعاع لبعض العناصر المشعة، التي يتم تضمينها داخل كبسولات أو تشكّل على هيئة حبيبات أو أسلاك أو توضع بأداة قثطرة، ثم يتم زرعها و تثبيتها مباشرة داخل أنسجة الورم أو قريبا منها، سواء لفترة قصيرة فحسب أو بشكل دائم، و تشمل المواد المشعة المستخدمة عادة، عناصر الراديوم و الايريديوم و الكوبالت و السيزيوم و اليود و الفوسفور.
و تُقلل بذلك من تعرّض الأنسجة الطبيعية للإشعاع، إضافة إلى أنها تسمح بإعطاء جرعات إجمالية عالية من الإشعاع في وقت اقصر من الوقت اللازم للإشعاع الخارجي، ويتم تحديد زمن بقاء الحشوات بمواضعها تبعاً لجرعة الإشعاع المطلوبة لتحقيق أقصى معالجة فعّالة.
أنواعه:
- الاشعاع البيني (داخل الورم)
- الاشعاع القنيوي (المري او الشعب الهوائية)
- الاشعاع التجويفي (تجويف الرحم)
- الحقن الوريدي لمواد مشعة على شكل سائل (كاليود لاورام الدرقية)
عند الزرع الدائم، تفقد الحشوات خاصّية الإشعاع بسرعة و تصبح غير مُشعّة عقب فترة قصيرة، و تنخفض كميات الإشعاع إلى مستويات آمنة قبل مغادرة المصحة، و على الرغم من ضآلة الإشعاع عموما، إلا انه قد يتم منع المريض و لعدة أسابيع من الاتصال المباشر بالآخرين، خصوصا الأطفال أو النساء الحوامل تجنبا لاحتمال تعرضهم للإشعاع. قد يستخدم الغراس او الحشوات مع الإشعاع الخارجي لدى بعض الحالات .
ومن أمثلة النظائر المشعة :
- الكوبالت: يستخدم في سرطان الحنجرة وسرطان المثانة البولية وسرطان المخ والعظام والرحم.
- الراديوم المشع: ويستخدم على هيئة بذور أو إبر تزرع في مكان المرض في حالات مثل سرطان اللثة وسرطان عنق الرحم .
- اليود: في تشخيص أمراض الغدة الدرقية وأيضاً في علاج بعض منها.
مثال: المعالجة الشعاعية المزروعة في اللسان Brachytherapy for a T1 N0 carcinoma
of the mobile tongue:
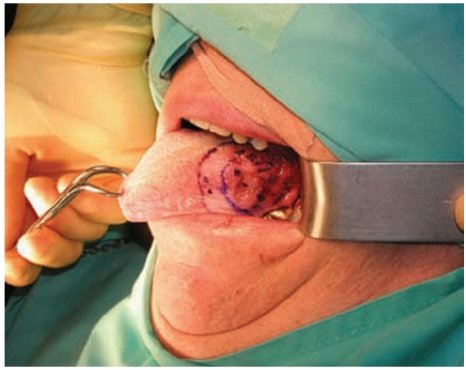


الإشعاع الخارجي External radiation
و يُعد النوع الأكثر تداولاً في معالجة أغلب أنواع الأورام، و يتم ذلك باستخدام آلة مولّدة للإشعاع تسمى بالمعجّل الخطي ( linear accelerator ) أو المتواتر، تقوم بتوليد و بث الأشعة المؤججة عالية الطاقة و توجيهها نحو النسيج الورمي، و مساحة معينة من الأنسجة المجاورة، و ثمة أنواع مختلفة من هذه الآلات تنتج أنماطاً مختلفة من الطاقة، و بعضها يستخدم في معالجة الأورام القريبة من سطح الجسم، بينما تختص أخرى بمعالجة الأورام المتواجدة عميقا داخل الجسم، و تُعد الأشعة السـينية الأكثر استخداما كمصدر للإشعاع عالي الطاقة،
و ثمة أنواع أخرى عديدة مستخدمة تبعا لنوع الورم و العمق المفترض بالأشعة أن تخترقه داخـل الجسم، مثل أشعة جـاما الناتجة عن نظائر الكوبالت المشـعّ أو حزمة من دفـق النيوترونـات أو البروتونات، أو شعاع الكهيربات ( electron beam ).
يتم إختيار الجرعة الكاملة بناء على:
- نوع الورم
- موقع الورم
- عمر المريض
- حجم العقد اللمفاوية المجسوسة
- المجاورات البشروية
- صحة المريض بشكل عام
غالبا يتم تقسيم الجرعة الكلية إلى جرعات اصغر حيث أن المعالجة تجري 5 أيام في الأسبوع لمدة 5-6 أسابيع هذا التقسيم يساعد النسج السليمة على ترميم نفسها. وهناك طريقة حديثة حيث تقسم الجرعة اليومية إلى جرعات اصغر بحيث تعطى مرتين أو ثلاث مرات في اليوم.
Tongue and mandibular positioning device:
العلاج الشعاعي معدل الشدة Intensity Modulated RT (IMRT)
أحدث أنواع المعالجات الشعاعية تستخدم جهاز حاسب مع برنامج خاص يضع خطة علاج دقيقة بحيث يوزع الجرعة على الأبعاد الثلاثة معتمداً على حجم الورم وشكله وتوضعه هذه الطريقة تُفيد في أنها تركز المقدار الأكبر من الأشعة على الورم بينما تكون الجرعة أقل بكثير على النسج السليمة المجاورة حيث تم توجيه الجرعة الاشعاعية من الاتجاهات الثلاثة بحيث تتقاطع في الورم.
الأعراض الجانبية واختلاطات العلاج الشعاعي
Side Effects and Complication of Radiotherapy
أنواع الانسجة الطبيعية:
- أنسجة سريعة التجدد (جلد, قناة هضمية, خلايا الدم, الخصية) تظهر عليها أعراض مبكرة.
- بطيئة التجدد (عضلات, انسجة ضامة, عظام, غضروف, اوعية دموية, غدد صم, كلية, كبد, رئة) تظهر التأثيرات بعد شهور- سنين.
- لا يوجد تجدد كالخلايا العصبية التي لا تتأثر والخلايا البويضية شديدة التأثر.

- التغيرات الدموية :(Blood changes) انخفاض اللمفاويات بعد عدة ساعات, انخفاض الخلايا متعدة النوى بعد يومين, انخفاض الكريات الحمراء والصفيحات بعد 7-10 أيام , تعود الأمور كما كانت بعد 2-3 أسبوع (غالبا).
و يجب ان يتم نقل كريات دم حمراء عندما يكون الهيماتوكريت بحدود 30% , نقل صفيحات عندما تكون 20000/ميكرو لتر اما نقل الكريات البيض ذات قيمة مشكوك بها و عند حدوث انتان يجب اجراء زرع واعطاء صادات واسعة الطيف.
Early and Late Side Effects of Radiotherapy:
|
المبكرة Early |
المتأخرة Late |
|
|
الأعراض الجانبية للعلاج الشعاعي في منطقة الرأس والعنق
side effects of the radiotherapy of the head and neck region
- نقص لعاب: يؤدي الى الاحساس بجفاف الفم والحلق ،صعوبة مضغ، اضعاف حاسة التذوق (حيث تضمر الحليمات الذوقية نفسها احساس معدني أو معدوم) قد تستمر هذه الأعراض لمدة عام يليه تحسن جزئي أو لا تتحسن عند الجرعة 60gy , حيث التغيرات غير عكوسة بسبب تأثر الجملة الوعائية الدقيقة في الغدد اللعابية و اللعاب لزج وسميك وينقص بحدة بعد اسبوع من بدأ المعالجة والعناصر المصلية هي المتأثرة غالبا, نخور عنقية تسبب كسر التيجان.
- التهاب وتقرح المخاطية.
- سقوط الشعر بعد 3 أسابيع من التعرض قد ينمو بعد 3 أشهر ويختلف في نوعيته .
- الساد و نستخدم واقي من الرصاص أمام العين لحمايتها.
- التهاب القناة السمعية الخارجية والأذن الوسطى والداخلية.
- فقدان مرونة جلد الرقبة.
- تليف في المفصل الفكي الصدغي .
- ضزز بسبب تأثر العضلات ايضا بعد 2-3 اشهر و يمكن ان يصبح دائما .
- تاثر نمو الفكين.
- تاثر براعم الاسنان الدائمة.
التنخر العظمي بسبب قلة ورود الدم وقلة الشفاء والفك السفلي ترويته أقل فهو أكثر خطورة من العلوي ويتظاهر بجرح مفتوح مؤلم رائحة كريهة عفنة مع عظم متنخر وقد لا تكون منتنة تشفى بشكل عفوي لكن ببطئ يعتمد ذلك على النسج المعرضة والجرعة وطريقة الاعطاء.
التعرض للمعالجة في طور النمو يؤدي لنقص اسنان او تأخر بزوغ و قد يؤدي لسوء تشكل وجهي قحفي. العلاج الشعاعي عن قرب أكثر خطورة من العلاج عن بعد.
ثانيا: المعالجة الكيميائية Chemotherapy:
نستخدمها عادة لمعالجة السرطانات المنتشرة ذات الانتقالات البعيدة و على الرغم من ضيق المؤشرات العلاجية لعدد من الادوية فان العلاج او حتى الشفاء لدى بعض المرضى يعتبر محتملا و يمكن ان تستخدم بشكل مشترك مع الجراحة و المعالجة الشعاعية.
العلاج يوزع على جلسات تتراوح فترة الراحة بينها من أسبوع إلى 4 أسابيع وتستمر إلى عدة أشهر أحياناً. تستغرق الجلسة الواحدة من عدة دقائق إلى ثلاث أو أربع ساعات وأحياناً لأيام.
Chemotherapy Treatment Regimes
- يمكن إعطاء العلاج عن طريق :
1. الفم .
2. الوريد (iv )
3. العضل (im)
4. تحت الجلد ((sc
5. داخل الورم (Intralesional )
6. الحقن في شريان رئيسي ( Intraarterial)
7. داخل تجاويف معينة مستهدفة و محددة (intracavitary )
8. تُحقن مباشرة في التجويف البطني داخل الصفاق intraperitoneal) )
9. في التجويف الصدري ( داخل غشاء الجنبة intrapleural )
10. تحقن بالجهاز العصبي المركزي عبر السائل الدماغي الشوكي ( الحقن الغِمدي Intrathecal)
الجرعات
و يُعد المليغرام وحدة قياس الجرعات المعتمدة، وتحسب الجرعة عند كل مريض بطريقتين، إما بناءً على وزن الجسم أو بناء على مساحته السطحية:
- بالنسبة لوزن الجسم قد تبلغ الجرعة القياسية لعقار ما 10 ملليغرام لكل كيلوغرام, بالتالي فالجرعة عند طفل يزن 30 كغ تبلغ 300 ملليغرام.
- أما المساحة السطحية للجسم ( body surface area BSA) فيتم حسابها بالمتر المربع بناءا على وزن و طول الجسم، حيث تساوي الجذر التربيعي لحاصل ضرب الطول بالسنتمتر في الوزن بالكيلوجرام مقسوما على العدد 3600، الجرعة القياسية للعقار 300 ملليجرام لكل متر مربع، بالتالي فالجرعة عند طفل يبلغ وزنه 30 كيلوجراما و طوله 125 سنتيمترا و مساحة جسمه السطحية 1.021 مترا مربعا ( أي تبلغ مترا مربعا واحدا تقريبا )، تكون 300 ملليجرام.
ومن الطبيعي أن تختلف الجرعات بين الأطفال والبالغين، كما قد يتم تعديل الجرعات تبعا لعوامل واعتبارات مختلفة، مثل :
- ضعف الحالة الغذائية للمريض.
- و العقاقير المصاحبة التي يتم تناولها.
- و مدى استخدام العلاج الإشعاعي أثناء دورة العلاج الكيماوي.
- إضافة إلى تعدادات الدم وتغيراتها.
- والمشاكل الصحية الأخرى وخصوصا بالكبد والكليتين.
مفعـول العـقاقير الكيميـائية
تعمل معظم الأدوية الكيماوية لتدمر الخلايا السرطانية بالتأثير على حمضها الريبو نووي ( DNA ) بعرقلته وتعطيله أو تفتيته و بالتالي إعاقة تسلسل دورة حياة الخلية في مراحلها المختلفة، مثل أطوار التكون و الانقسام والتكاثر والنمو، سواء بالتداخل مع عملية تركيبه أو أعاقة وظائفه أو التأثير على كيميائية الخلية، إضافة إلى تعطيل و تقويض عمليات بناء البروتينات النووية داخل الخلايا، و يختلف كل عقار في طريقة عمله و المرحلة التي يتدخل و يؤثر فيها على دورة حياة الخلية.
تشمل الفئات الرئيسية من العقاقير الكيماوية :
- عناصر الألكلة alkylating agents
- العقاقير كابحة الأيض antimetabolites
- المركبات المشتقة من قلوانيات نباتيةplant alkaloids
- المضادات الحيوية ضدية الأورام antitumor antibiotic
- إضافة إلى فئات أخرى متنوعة مضادة لنمو الأورام تعمل بطرق غير مباشرة، مثل الهرمونات الستيرويدية و الإنزيمات المُعرقلة لإنتاج البروتينات و مضادات الأجسام الغريبة التي تدعم الجهاز المناعي
- عناصر الألكـلة alkylating agents
تتداخل مع عمليات انقسام الخلية و تقوم بتفتيت هيكلة الحمض النووي في كل مراحل دورة حياة الخلية، أكثر أنواعها تداولاً هو عقار السيكلوفسفامايد Cyclophosphamide .
- مانعات الأيـض antimetabolites
و هي تقوم بإعاقة و تعطيل نمو الخلية بالتدخل في بعض النشاطات الحيوية و عمليات الأيض خصوصا عمليات تكوين الحمض النووي و تحولاته، أنواعها الأكثر تداولا هي العقاقير 6- ميركابتوبيورين mercaptopurine، و السايتارابين Cytarabine، و 5- فلوراويوراسيل fluorouracil.
- المضـادات الحيـوية ضديّة الأورام
و بصفة عامة تقوم بالاندماج في الحمض النووي مجمدة بذلك تحولات حمض ريبونوكليك الذي يتحكم في تصنيع البروتينات النووية، مما يؤدي إلى موت الخلايا، من أنواعها : عقار دوكسوروبيسين doxorubicin / Adriamycin و عقار الميتومايسين mitomycin-C و بليومايسين bleomycin .
- القلوانيات النباتية Plant ( vinca ) alkaloids
و المستخرجة من نبتة الفنكة أو العناقية، و هي تقوم خصوصا بمنع الخلايا من الانقسام و التكاثر خلال عمليات الانقسام الخلوي، من أنواعها : عقار فينكريستين Vincristine و فينبلاستين vinblastine.
- كابحات الإنزيمات المُرمّمة للحمض النووي DNA-repair enzyme inhibitors
و هي تقوم بتفتيت البروتينات المسؤولة عن إصلاح الحمـض النووي بالخلايا السرطانية، و عمليات تصحيح الحمـض النووي و إصلاح أنساقه هي من العمليات الحيوية الهامة بالخلايا، و بمنعها تصبح الخلايا السرطانية أكثر عرضة للتقويض و التضرر و تفقد المقدرة على النمو، من أنواع هذه الكابحات : عقار ايتوبوسايد etoposide وتوبوتيكان topotecan .
الأعراض الجانبية للمعالجة الكيماوية
الفموية
- تسبب التهاباً وأحياناً تقرحات في الفم أيضاً.
- قد تسبب فقدان مؤقت لحاسة التذوق.
- من المهم أن يكون الفم نظيفاً ورطباً دائماً.
العامة
- تثبيط النقي ،فقر دم, نقص البيض, نقص الصفيحات
- غثيان, اقياء
- التهاب المعدة و البلعوم
- اذية الخلايا الكبدية
- اندفاعات حمامية, التهاب الاجربة, فرط تصبغ،
- قصور كلوي
- حمى
- تليف رئوي
- انسمام قلبي
- اعتلال الاعصاب المحيطية
تدبير المريض المعرض للمعالجة الشعاعية او الكيماوية فمويا
عندما يحدد الموعد ليبدأ المريض معالجة الرأس والعنق يجب ان يتم عمل تقييم فكي سني شامل يتضمن فحص سريري وشعاعي لكامل الفكين
- ان خطة المعالجة قبل البدء في العلاج الشعاعي تتطلب التخلص من الاسنان الموؤفة ومعالجة الاسنان المصابة اجراء معالجة لثوية لكامل الفم وينصح باستعمال الفلور اليومي.
- ويجب على طبيب الاسنان ان يعرف ما هي المناطق التي سيتعرض اليها المريض بالاشعة فيركز بشكل اساسي على علاج هذه المناطق والقلع في مثل هذه الحالة لا يختلف عن اية اجراءات اخرى حسب حالة المريض.
- على ان تنتهي المعالجة والقلع قبل 15 يوما من بدء المعالجة الشعاعية للسماح بالشفاء الكامل وان لم يكن هناك امكانية يجب الانتظار لتكون تغطية بشرية لتجويف القلع غير تارك أي عظم مكشوف.
- اما اثناء التعرض للاشعة فيفضل تجنب أي عمل سنية خلال هذة الفترة وخصوصا القلع و الوقاية المستمرة من حدوث أي انتان ومراعاة التغيرات الفموية واللثوية الحاصلة في النسج
- بعد المعالجة
- المعالجة المحافظة هي المطلوبة والمستحبة
- معالجة لبية أفضل من القلوع وتتم مع تغطية وتجنب دفع المواد المتموتة لبعد الذروة
- التعويضات المتحركة هي المستطبة مع الانتباه لوجود تخريش أو تقرح ووضع مبطنات طرية لمدة 2-3 أشهر
- برنامج تدريب فكي عند حدوث ضزز
- اعطاء المريض مستحضرات لعاب صنعية
- مضمضة بيكربونات الصوديوم كغسول الفم 4 مرات باليوم, 10مرات باليوم بمحلول ملحي و كلور الهكسيدين مرتين باليوم
- التفريش بفرشاة ناعمة عدة مرات بعد وجبات الطعام
- اما بالنسبة للجراحة والقلع فيمكن اجرائها بعد مضي 6-12 شهرا على انتهاء العلاج مع التغطية بالصادات الحيوية ومراعاة تجنب الرض وخصوصا في المناطق التي تعرضت للاشعة تجنبا لحصول التهاب عظم ونقي. مع عدم ترك شؤوذات واغلاق الجرح وعدم ترك عوامل مرقئة داخل السنخ لأنها تصبح بؤرة انتان.
- الخوف يكمن من حدوث تنخرشعاعي عظمي: معالجة التنخر الشعاعي العظمي تكون بإزالة الشظايا العظمية مع جزء من العظم السليم مع الرد الجراحي و اعطاء الصادات الحيوية.
- وهذه التعليمات تنطيق على المعالجة الكيماوية لذا ينصح باجراء معظم المعالجات السنية الضرورية قبل البدء بالمعالجة الكيماوية, بعد البدء ينصح بالتوقف عن اجراء أي معالجة سنية ما لم تكن ضرورية .
- في هذه الحالة عند اجراء القلع يجب التاكد على القراءة الجيدة لتعداد الدم وصيغته (كريات الحمراء والبيضاء وعدد صفيحات الدموية). خطورة نزف اذا كان تعداد الصفيحات اقل من 20,000ملم2 حيث الحد الادنى المطلوب للقلع 50,000/ملم2 مع التغطية بالصادات الحيوية المناسبه بالاتفاق مع الطبيب المعالج. وينصح باستعمال مضامض كلور هكسيدين مع مضادات الفطور عند الضرورة.
- يجب الانتباه الى المرضى الذين احتاجوا الى نقل نخاع العظام حيث يتلقون علاج بمثبطات المناعة.
الأورام المتعلقة بالرأس والعنق حسب طرائق علاجها
|
الاورام التي تستجيب للعلاج الشعاعي |
الأورام التي تستجيب للعلاج الكيماوي |
|
|
|
المعالجة الشعاعية مع الجراحية |
المعالجة الشعاعية مع الكيميائية |
|
|
|
المعالجة الشعاعية مع الكيميائية مع الجراحية | |
|
